
Mit der Gen-Schere gegen das PRRS-Virus: Resistente Schweine in den USA zugelassen
Für die Schweine ist es eine Qual, Landwirten beschert es hohe Kosten – das PRRS-Virus, Erreger der weltweit bedeutendsten Schweinekrankheit. Ein wirksames Gegenmittel gab es bisher nicht. Doch das hat sich geändert: Am Roslin Institute in Edinburgh haben Wissenschaftler Schweine entwickelt, die „vollständig immun“ gegen das Virus sind – dank der Gen-Schere CRISPR/Cas. Inzwischen ist das neue Merkmal in verschiedene Zuchtlinien eingebracht. Anfang 2025 hat die US-amerikanische Lebensmittelbehörde FDA die PRRS-resistenten Schweine zugelassen. Schon bald werden sie wohl dort auf den Markt kommen. Fremdes Erbmaterial besitzen diese Schweine nicht.
Das PRRS-Virus (Porcine Reproductive and Respiratory Syndrome) ist Auslöser für die Schweineseuche mit den weltweit größten Verlusten in der Schweinehaltung. Die Kosten für die Bekämpfung der Seuche und für die Ertragsausfälle in der Landwirtschaft summieren sich weltweit auf etwa 2,2 Milliarden Euro.

Gen-editierte Schweine: Ihnen fehlt ein kleiner Bereich eines Proteins, welches das Virus nutzt, um in Zellen einzudringen und sich zu vermehren. Obwohl diese Schweine dem PRRS-Virus ausgesetzt wurden, blieben sie gesund und zeigten keine Anzeichen einer Infektion.
Fotos: Norrie Russell, Roslin Institute; Grafik oben: ahasoft2000/123RF
Erstmals wurde das PRRS-Virus 1987 in Nordamerika identifiziert, in Europa vier Jahre später. Inzwischen soll es in Deutschland in 70 bis 90 Prozent aller Schweinebetriebe nachweisbar sein, allen aufwändigen Schutz- und Hygienemaßnahmen zum Trotz. Es befällt die Immunzellen der Lungen, die Folgen sind Erkrankungen der Atemwege und eine erhöhte Anfälligkeit für andere Infektionen. Noch gravierender sind die Schäden, die das PRRS-Virus im Fortpflanzungsbereich der Tiere hervorruft. Es kommt zum Absterben der Ferkel im letzten Teil der Trächtigkeit der Sau. Oft werden die Ferkel zu früh geboren, sind krank und entwickeln sich schlecht.
Das Virus wird innerhalb der Herden als Tröpfcheninfektion über die Luft verbreitet, kann aber auch durch Wind über einige hundert Meter weit transportiert werden.
Inzwischen gibt es zwar verschiedene Lebend- und Totimpfstoffe, doch die Bekämpfung der PRRS-Seuche ist für Schweinehalter kompliziert und wenig erfolgreich. Das Virus ist wandlungs- und anpassungsfähig: Es existieren verschiedene Typen und zahlreiche, sich immer wieder verändernde genetische Varianten. Es ist schwer und erfordert viel Fachkenntnis, einen Bestand mit der jeweils richtigen Impfstrategie auf Dauer gesund zu halten. In den USA sieht man es als gescheitert an, das Virus mit Impfstoffen kontrollieren zu wollen.
Versuche, mit herkömmlicher Gentechnik PRRS-resistente Schweine zu erzeugen, blieben erfolglos. 2016 eröffnete sich ein ganz neuer Weg. US-amerikanische Wissenschaftler hatten ein Rezeptor-Protein (CD163) auf der Oberfläche bestimmter Immunzellen als „Einfallstor“ für das Virus identifiziert. Sollte es gelingen, das CD163-Protein gezielt ausschalten, blieben die Zellen für das Virus verschlossen und es könnte sich dort nicht vermehren.
„Wir haben bei den Schweinen eine vollständige Immunität erreicht.“
Doch erst mit der Gen-Schere CRISPR/Cas, dem ambitioniertesten der neuen Genome Editing-Verfahren wurde es möglich, bestimmte Gene gezielt anzusteuern und sie zu inaktivieren, ohne dafür fremdes Genmaterial einführen zu müssen. Das funktionierte auch gegen die PRRS-Seuche: In befruchteten Schweine-Eizelle wurde ein DNA-Abschnitt des CD163-Gens blockiert – das entsprechende Protein wird nicht mehr gebildet. Die daraus hervorgegangenen Schweine zeugten Nachkommen, deren Zelloberfläche nachweislich frei von intaktem CD163-Protein sind. In ersten Versuchen erwiesen sie sich als tatsächlich PRRS-resistent.
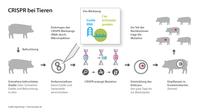
Gezielte Mutationen mit CRISPR/Cas bei Schweinen (schematische Darstellung)
Eine Forschergruppe am Roslin Institute im schottischen Edinburgh entwickelte den Ansatz weiter. Mit Hilfe des CRISPR/Cas-Systems blockierte sie nicht das gesamte CD163-Protein, sondern nur eine kleine, ganz bestimmte Region (Domäne) in dem verzweigten Molekül, die jedoch für das Eindringen der PRRS-Viren ins Zellinnere und ihre Vermehrung entscheidend ist. Damit konnte die normale Funktion des Rezeptors erhalten und die Gefahr von Nebeneffekten reduziert werden. Nur 450 von etwa drei Milliarden Basenpaaren im Schweinegenom wurden mit der CRISPR-Technik inaktiviert.
Nach ersten Tests mit einzelnen Zellen zogen die Roslin-Wissenschaftler vier Schweine mit verändertem CD163-Protein auf und hielten sie mit vier normalen Schweinen in einem gemeinsamen Stall. Alle Schweine wurden mit dem PRRS-Virus infiziert: Nur die editierten Schweine blieben gesund. Bei ihnen waren auch keine PRRS-Antikörper nachweisbar: Das deutete darauf hin, dass tatsächlich keine Infektion stattgefunden hatte. Auch in anderen Zellgeweben und im Blut fanden sich keine Hinweise auf eine Erkrankung. „Wir bezeichnen das als vollständige Immunität“, so Christine Trait-Burkard, Leiterin der Arbeitsgruppe am Roslin Institute.
PRRS-resistente Schweine: In den USA zugelassen
Anschließend wurde das Projekt von Genus PLC, einem Unternehmen für Nutztiergenetik, und einem weltweit aktiven Schweinezüchter (PIC, Pig Improvement Company) in den USA fortgesetzt. Dort sind die Rahmenbedingungen weniger restriktiv als in Europa. Die CRISPR-gesteuerte Teil-Blockade des CD163-Gens wurde in vier genetisch unterschiedliche Elitezuchtlinien eingeführt. Diese Schweine brachten gesunde PRRS-resistente Ferkel zur Welt. Die Tiere dieser Herde werden auf Gesundheit und mögliche Nebeneffekte untersucht, ebenso die Wirksamkeit der PRRS-Resistenz über mehrere Generationen.
Anfang 2025 erteilte die US-amerikanische Lebensmittelbehörde FDA die Zulassung für die „Technologie zur Zucht von PRRS-resistenten Schweinen“. Es gebe keine Sicherheitsbedenken für solche gen-editierten Schweine, weder für den menschlichen Verzehr, noch für die Umwelt. „Wir haben Jahre damit verbracht, umfangreiche Forschungen durchzuführen, unsere Ergebnisse zu validieren und mit der FDA zusammenzuarbeiten, um die Zulassung zu erhalten“, so ein Sprecher von Genus.
Im Lauf des nächsten Jahres könnte das Fleisch in den Handel kommen. Doch bevor die kommerzielle Vermarktung in den USA beginnt, sollen die editierten Schweine auch in den wichtigen Exportländern zugelassen werden, etwa Mexiko, Kanada, Japan oder China. Brasilien und Kolumbien haben diese bereits erteilt, dort sind PRRS-resistente Schweine konventionellen gleichgestellt.
Seit Mai 2019 besteht eine Kooperation zwischen Genus PLC und Beijing Capital Agribusiness (BCA), einem der wichtigsten Schweinezuchtunternehmen in China: Das Land ist der mit Abstand größte Produzent und Importeur von Schweinefleisch. BCA bemüht sich derzeit um die vollständige Zulassung der virusresistenten Schweine in China.
In Europa ist an eine Zulassung solcher genom-editierter Schweine vorerst nicht zu denken. Die Erleichterungen bei der Zulassung einfacher gen-editierter Pflanzen (NGT), wie sie derzeit in der EU beraten werden, gelten ausdrücklich nicht für Tiere – auch wenn die editierten, PRRS-resistenten Schweine kein fremdes Genmaterial enthalten. Zudem kämen nach einer Zulassung nicht die editierten Tiere selbst, sondern nur ihre Nachkommen aus mehreren Generationen in den Handel. In ihnen ist nur das neue, vererbbare Merkmal – die PRRS-Resistenz – vorhanden.
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen

Gene-edited pigs are resistant to billion dollar virus, study finds.
Im Web
- The Roslin Institute, Gene-edited pigs approved for US market; 01 May 2025
- FDA approval for technology to breed PRRS-resistant pigs, PIG Progress 02 May 2025
- FDA, Intentional Genomic Alterations (IGAs) in Animals; 30 Apr 2025
- Burger B.T. et a. (2024): Generation of a Commercial-Scale Founder Population of Porcine Reproductive and Respiratory Syndrome Virus Resistant Pigs Using CRISPR-Cas. The CRISPR Journal, 12-28; 14. Feb 2024
- Chen, J. et al. (2019): Generation of Pigs Resistant to Highly Pathogenic-Porcine Reproductive and Respiratory Syndrome Virus through Gene Editing of CD163. Int J Biol Sci. 15(2): 481–492.
- Genus plc partners with BCA to progress PRRSv resistant pigs in China. National Hog Farmer, 16.05.2019
- Gene-edited pigs are resistant to billion dollar virus, study finds. The Roslin Institute, 26.06.2018
- Burkard, C. et al. (2018) Pigs lacking the scavenger receptor cysteine-rich domain 5 of CD163 are resistant to PRRSV-1 infection, Journal of Virology
- Burkard, C. et al. (2017) Precision engineering for PRRSV resistance in pigs: Macrophages from genome edited pigs lacking CD163 SRCR5 domain are fully resistant to both PRRSV genotypes while maintaining biological function, PLOS|Pathogens








